作者: 来源:纳米抗体研究重点实验室 发布时间:2025-05-30
哮喘是一种以气道慢性炎症和2型免疫反应为特征的异质性疾病,多数重症患者表现为“2型炎症”表型。胸腺基质淋巴细胞生成素(TSLP)和白介素13(IL 13)是驱动该炎症的核心细胞因子。虽然已有单靶点生物制剂(抗TSLP或抗IL 13)获批,但其疗效仍存在天花板效应。同时阻断TSLP与IL 13能否实现协同增效,成为新的研究方向。2025年发表于《欧洲呼吸杂志》的一项1b期研究,首次报告了双特异性纳米抗体药物lunsekimig在哮喘患者中的机制验证结果。
【原文链接】https://publications.ersnet.org/content/erj/65/4/2401461
背景与目的
科学问题:TSLP作为上游警报素,可启动炎症级联反应;IL 13则直接促进嗜酸性炎症、黏液分泌与气道高反应性。两者在2型炎症通路中具有互补作用,但双靶点阻断在人体中的安全性、耐受性及药效学效应尚未明确。
研究目标:评估lunsekimig(一种同时靶向TSLP和IL 13的双特异性纳米抗体分子)单次给药在轻度‑中度哮喘患者中的安全性、耐受性及其对2型炎症生物标志物和肺功能的影响。
结果与结论
1. 良好的安全性与耐受性
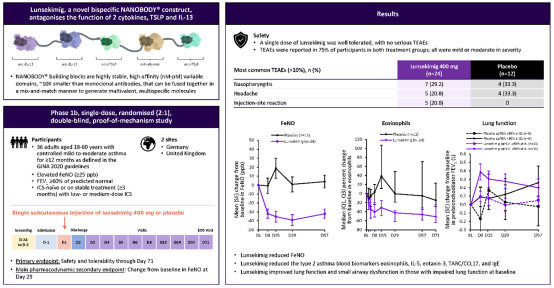
36例患者(lunsekimig 400 mg组24例,安慰剂组12例)全部完成研究。两组治疗相关不良事件发生率均为75%,均为轻度或中度,无严重不良事件。最常见不良事件为鼻咽炎、头痛和注射部位反应。
2. 快速且持久的2型炎症抑制
FeNO(呼出气一氧化氮):lunsekimig组从第8天起FeNO即显著降低,第29天时较安慰剂组平均降低40.9 ppb(p<0.0001),37.5%患者FeNO恢复正常(<25 ppb)。
血液生物标志物:嗜酸性粒细胞从第2天开始下降,第29时几何均值比值(lunsekimig/安慰剂)为0.48(p<0.001);IL 5、嗜酸粒细胞趋化因子 3、TSLP等均显著降低。
3. 早期改善肺功能,尤其在小气道
第8天即观察到FEV₁显著改善(与安慰剂组差值0.348 L,p=0.003)。在基线肺功能受损(ppFEV₁<80%)的亚组中,肺功能数值改善更明显,且维持至第57天。小气道功能指标(FEF₂₅–₇₅%、R5–20、AX)也显示早期改善,提示药物对小气道功能障碍有积极作用。
4. 药代动力学与靶点结合
半衰期约10.8天,与健康志愿者数据一致。给药后总TSLP和IL 13浓度升高,表明药物与靶点有效结合。
创新与意义
1. 首款哮喘双特异性纳米抗体药物
lunsekimig基于纳米抗体平台,由5个纳米抗体模块构成,分子量仅为传统抗体的约1/10,无Fc段,可避免Fc介导的效应功能。
2. 验证“双靶点协同”机制
单次给药即实现强效且持久的2型炎症抑制,FeNO降幅超过既往单靶点抗体报告值(‑40.9 ppb vs. 单靶点约‑6至‑13 ppb),提示同时阻断TSLP与IL‑13可能存在协同效应。
3. 凸显小气道作为关键治疗靶区
研究通过振荡肺功能检测发现小气道功能早期改善,为哮喘治疗提供了新的生理学洞察。小气道功能障碍与哮喘控制不佳、急性加重风险密切相关。
4. 为临床开发提供明确路径
该机制验证研究为后续IIb期疗效试验(AIRCULES研究)奠定基础,未来将评估lunsekimig在减少急性加重、延缓肺功能下降方面的长期获益。
总结
本研究首次证实,双特异性纳米抗体药物lunsekimig单次给药在轻度‑中度哮喘患者中安全性良好,并能快速、显著抑制2型炎症生物标志物,改善肺功能尤其是小气道功能。该结果不仅验证了双靶点TSLP/IL‑13阻断的协同治疗潜力,也展示了纳米抗体平台在开发多靶点生物制剂中的独特优势,为哮喘的精准免疫治疗开辟了新方向。
上一篇:科研分享:基于STING激动剂的内质网靶向分子促进抗原交叉呈递
下一篇: